Siguiente: Ejemplo 13, Anterior: Ejemplo 11, Subir: Ejemplos de calorimetría [Índice general][Índice]
15.12 Ejemplo 12
Un calorímetro de cobre de 105 g contiene 307 g de agua a 23 C. Si se adicionan 95 g de hielo a -4 C al calorímetro, ¿Cual es la temperatura final del sistema en grados Celsius? (Calor especifico del hielo = 2090 J/kg*K, calor especifico del agua = 4187 J/kg*K, calor especifico del cobre = 390 J/kg*K, y calor de fusión del agua = 79.7 cal/g).
Solución con FísicaLab
Seleccionamos el grupo Termodinámica y, dentro de este, el módulo Calorimetría y gases. Si la Pizarra contiene elementos, los borramos dando un clic en el icono Borrar todo. Y ahora agregamos a la Pizarra un elemento Calorímetro, dos elementos Bloque, dos elementos Liquido, un elemento Cambio de fase solido-liquido y un elemento Proceso, como muestra la siguiente imagen (el circulo en amarillo encierra los elementos que representan el cambio sufrido por el hielo):
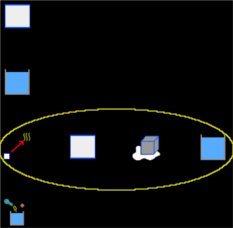
Para el elemento Bloque, que representa el calorímetro de cobre y que llamaremos justamente Cobre, tenemos:
- Nombre
Cobre
- m
105 @ g
- c
390
- Ti
23 @ C
- Tf
Tf @ C
Para el elemento liquido, que representa el agua dentro del calorímetro y que llamaremos Agua, tenemos:
- Nombre
Agua
- m
307 @ g
- c
4187
- Ti
23 @ C
- Tf
Tf @ C
Ahora, vamos a suponer que el hielo se derrite completamente y que el liquido resultante alcanza una temperatura mayor a los 0 C. Entonces para el segundo elemento Bloque, que representa al hielo en el intervalo de temperatura -4 C a 0 C y que llamaremos HieloA, tenemos:
- Nombre
HieloA
- m
95 @ g
- c
2090
- Ti
-4 @ C
- Tf
0 @ C
Ahora para el elemento Cambio de fase solido-liquido, que representa la fusión del hielo y que llamaremos HieloB, tenemos:
- Nombre
HieloB
- m
95 @ g
- cf
79.7 @ cal/g
- Sentido
>
Y para el segundo elemento liquido, que representa el agua liquida obtenida al derretirse el hielo y que llamaremos HieloC, tenemos:
- Nombre
HieloC
- m
95 @ g
- c
4187
- Ti
0 @ C
- Tf
Tf @ C
Ahora para el elemento Proceso, que representa el cambio total sufrido por el agua del hielo y que llamaremos Hielo, tenemos:
- Nombre
Hielo
- Objeto 1
HieloA
- Objeto 2
HieloB
- Objeto 3
HieloC
- Objeto 4
0
- Objeto 5
0
Obsérvese que la temperatura final es la misma incógnita en todos los elementos, tal y como debe ser. Por último, para el elemento Calorímetro:
- Objeto 1
Cobre
- Objeto 2
Agua
- Objeto 3
Hielo
- Objeto 4
0
Ingresados los datos, damos un clic en el icono de Resolver para obtener la respuesta:
Tf = -1.154 C ; Estado = success. Verifique que la temperatura calculada este dentro del rango esperado. Si no es asi, algun proceso o cambio indicado, nunca se lleva a cabo debido a que la energía no es suficiente.
El mensaje de advertencia nos dice que debemos verificar que la temperatura este dentro del rango esperado. Obviamente la temperatura final obtenida no esta dentro del rango esperado, puesto que asumimos que el hielo se derretía completamente y que el agua liquida resultante adquiría una temperatura final superior a 0 C. Esto indica (como nos dice el mensaje de advertencia) que algún proceso no se lleva a cabo. La posibilidad inmediata es que la energía del calorímetro y del agua, no sea suficiente para derretir todo el hielo. Así que vamos a asumir que el hielo si alcanza los 0 C, pero que solo parte de este se derrite. Eliminamos por tanto el elemento Liquido, que representa el agua obtenida del hielo, y borramos también su nombre del elemento Proceso. La temperatura final ya no es entonces una incógnita, porque si solo parte del hielo se derrite, entonces la temperatura final es 0 C. La nueva incógnita es la masa de hielo que se funde. Así, los elementos de la nueva hipótesis quedan como muestra la siguiente imagen:
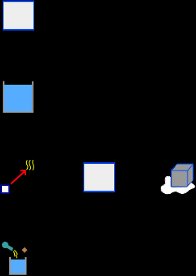
Eliminamos el nombre HieloC del elemento Proceso:
- Nombre
Hielo
- Objeto 1
HieloA
- Objeto 2
HieloB
- Objeto 3
0
- Objeto 4
0
- Objeto 5
0
En el elemento Cambio de fase solido-liquido, la masa es ahora una incógnita (dejamos el factor de conversión de gramos):
- Nombre
HieloB
- m
m @ g
- cf
79.7 @ cal/g
- Sentido
>
Y en los elementos que representan al cobre y al agua del calorímetro, la temperatura final es ahora 0 C:
- Nombre
Cobre
- m
105 @ g
- c
390
- Ti
23 @ C
- Tf
0 @ C
- Nombre
Agua
- m
307 @ g
- c
4187
- Ti
23 @ C
- Tf
0 @ C
Replanteado el problema, damos un clic en el icono de Resolver para obtener la respuesta:
m = 89.037 g ; Estado = success.
Por lo tanto, la temperatura final es de 0 C, derritiéndose únicamente 89 g de hielo.